Quantenmechanische Berechnung der Energieniveaus des Wasserstoff-Atoms
Um die Schrödingergleichung im Coulomb-Potential zu lösen, schreibt man sie in Kugelkoordinaten. Die Wellenfunktion lässt sich dann in einen Radial- und einen Winkelanteil separieren:
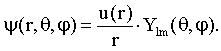
Für die radiale Wellenfunktion u(r) ergibt sich dann die folgende Gleichung:
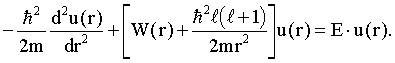
Dabei ist W(r) das Coulomb-Potential. Bei dieser Gleichung handelt es sich um eine Eigenwertgleichung (vgl. Kapitel 8.6), bei der neben der Wellenfunktion ψ auch noch die erlaubten Werte der Energie E zu bestimmen sind. Die Gleichung wird üblicherweise mit einem Potenzreihenansatz gelöst. Die Lösungsfunktion, die sich ergibt, ist die sogenannte konfluente hypergeometrische Reihe.
Der entscheidende Punkt dabei ist: Für r → ∞ divergiert die Lösungsfunktion im Allgemeinen. Das würde bedeuten, dass die Wahrscheinlichkeit, das Elektron im Unendlichen anzutreffen, gegen Unendlich geht. Das Eigenwertproblem hat keine physikalisch akzeptable Lösung. Nur wenn die Bedingung
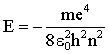
erfüllt ist, geht die Radialfunktion für r → ∞ gegen Null. Die Tatsache, dass im Wasserstoffatom nicht alle Energien möglich sind (wegen der Quantisierung der Energie) geht also auf die physikalisch geforderten Randbedingungen zurück (hier: die Lösung muss im Unendlichen gegen Null gehen). Das ist ganz analog zum unendlich hohen Potentialtopf, wo die Lösung am Rand des Potentialtopfs Null werden muss.
Generell gilt also die Aussage: Die Quantisierung der Energie geht auf die Randbedingungen zurück, die man an die Wellenfunktion stellt.
