Die folgenden Beispiele stellt uns freundlicherweise Dr. Felix Schumacher aus Essen zur Verfügung.
Periodische Randbedingungen
Die sechs p-Elektronen in einem Benzolring (C6H6) stellen ein System von drei konjugierten Doppelbindungen dar, die letztlich völlig delokalisiert sind, also – in der Sprache der Chemiker – über das ganze Molekül verschmiert sind. Die Wellenfunktionen dieser Elektronen haben in der Molekülebene eine Knotenebene, und im Folgenden soll nur das Verhalten längs des Benzolringes betrachtet werden; dadurch liegt dann tatsächlich ein eindimensionales Problem vor. Man erhält folgende Eigenfunktionen (L ist der vorläufig unbekannte Umfang des Benzolringes):
Zustände gerader Parität:
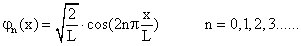
Zustände ungerader Parität:
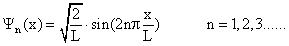
Grundzustand:
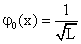 (also eine konstante Funktion).
(also eine konstante Funktion).
Der Eindeutigkeit halber kann man sich vorstellen, dass x der Abstand des Elektrons von einem speziellen C-Atom ist, gemessen entlang des Benzolringes. Die Wellenfunktion muss dann die Periode L aufweisen.
Im Folgenden soll der Umfang des Benzolringes, das ist die Größe L, abgeschätzt werden. Bis auf den Grundzustand sind alle Zustände zweifach entartet. Nimmt man das Pauli-Prinzip zu Hilfe, dann ist unter Berücksichtigung des Spins der Elektronenzustand mit n = 0 doppelt und mit n = 1 vierfach besetzt. Die erste Anregung erfolgt von n = 1 nach n = 2.
Wegen der periodischen Randbedingung muss zusätzlich gelten:
Die Energieeigenwerte sind die folgenden:
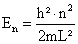 .
.Also lautet die zugehörige Energiedifferenz :
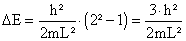 .
.
Optisch liegt dieser Übergang im UV bei l = 200 nm; setzt man
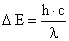 , erhält man
, erhält man 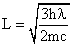 .
.
Unter der Wurzel stehen nur Naturkonstanten und die Messgröße l = 200 nm. Damit kann man den Umfang des Benzolringes bestimmen; man erhält L = 0,832 nm. Der Abstand zweier C-Atome im Benzolring ergibt sich daraus zu
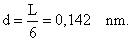
In der Literatur wird d = 0,139 nm angegeben. Das ist eine Abweichung von lediglich 2%.
Das Modell liefert bei der räumlichen Verteilung der p-Elektronen längs des Benzolrings eine konstante Wahrscheinlichkeitsdichte. Dies ist eine typische aromatische Verbindung.
Ein Anwendungsbeispiel für den linearen Potentialtopf mit unendlich hohen Wänden sind die Polyene, lineare Kohlenstoff-Wasserstoffverbindungen mit konjugierten Doppelbindungen. Betrachtet man die Verbindungen der p-Elektronen entlang des Moleküls (z.B. b-Carotin), so zeigt sich, dass die Antreffwahrscheinlichkeit an den Enden des Moleküls am größten ist. Bei den Additionsreaktionen lagern sich die Atome immer an den Enden des Molküls an.
